| I) INTRODUCTION Un acide est dit faible lorsque son ionisation en solution aqueuse est partielle (donc réversible et limitée à un équilibre). Pour un acide faible de formule HA, on peut écrire
HA + H2O  H3O+ + A- H3O+ + A-
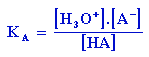 Cette constante, appelée constante d'acidité ou KA, permet de caractériser la force relative de cet acide. Plus l'acide est fort, plus son ionisation est marquée et plus sa constante d'acidité est élevée. Cette constante, appelée constante d'acidité ou KA, permet de caractériser la force relative de cet acide. Plus l'acide est fort, plus son ionisation est marquée et plus sa constante d'acidité est élevée.
A tout acide faible HA est associé une base faible A-. Les espèces HA et A- forment un couple acide-base et A- est appelée base conjuguée de HA.
Il est aisé de comprendre que plus la forme acide du couple est forte, plus la forme basique sera faible. Ainsi le KA sert aussi à classer les bases faibles en fonction de leur force respective.
La détermination du KA est donc importante pour le chimiste. Actuellement il existe des tables reprenant les constantes d'acidité de nombreux couples. Nous allons voir comment, expérimentalement, il est possible de déterminer la valeur de cette constante.
Le traitement des données expérimentales se fera à l'aide du tableur Excel de Microsoft. L'outil informatique permet entre autres d'automatiser, simplifier une tâche fastidieuse.
 II) LE PRINCIPE DE LA MANIPULATION : II) LE PRINCIPE DE LA MANIPULATION :
Soit une solution d'acide faible HA de concentration CA et une solution de base forte de concentration CB.
A VA ml de HA on ajoute VB ml de base. On a alors
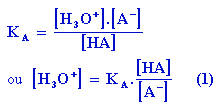
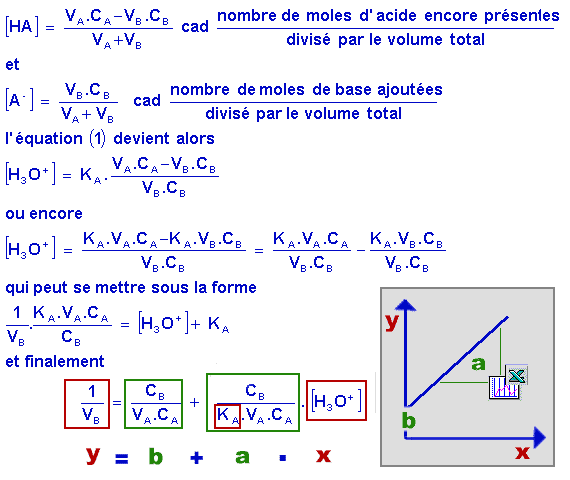
En observant plus en détail cette équation apparemment complexe on constate qu'elle se ramène à l'équation d'une droite (Les grandeurs KA, CA et CB sont fixées initialement. Ce sont donc des constantes.).
Supposons maintenant que, pour un même volume initial constant VA d'acide faible, on ajoute différents volumes VB de base. On constate que, d'après l'équation ci-dessus, le pH va varier. Si on mesure à chaque ajout le pH, on va obtenir un ensemble de couples de points VB et [H3O+].
L'équation nous montre qu'en portant en graphique 1/VB en fonction de [H3O+] on obtient une droite (y = b + a.x) dont le coefficient angulaire (pente) (a) nous permet de déterminer KA.
C'est donc à partir du graphique que nous pourrons déterminer KA.
 III) LA MANIPULATION : III) LA MANIPULATION :
- Préparer une solution de NaOH CB = 0,1M
- Préparer une solution CA = 0,1M en CH3COOH (éthanoïque ou acide acétique).
- Préparer une solution CA = 0,1M en HCOOH (méthanoïque ou acide formique).
- Monter un dispositif de titrage volumétrique avec
- dans la burrette 50ml de NaOH CB = 0,1M
- dans l'erlenmeyer VA = 25ml de l'acide CA = 0,1M
- Ajouter progressivement les volumes VB de base tels qu'indiqués dans le tableau et mesurer le pH au pH-mètre (de préférence) ou au papier indicateur .
- Compléter le tableau
| VB [en ml] |
1/VB [en l-1] |
méthanoïque
|
éthanoïque
|
| pH |
[H3O+] |
pH |
[H3O+] |
| 2 |
|
|
|
|
|
| 4 |
|
|
|
|
|
| 6 |
|
|
|
|
|
| 8 |
|
|
|
|
|
| 10 |
|
|
|
|
|
| 12 |
|
|
|
|
|
| 14 |
|
|
|
|
|
| 16 |
|
|
|
|
|
| 18 |
|
|
|
|
|
| 20 |
|
|
|
|
|
| 22 |
|
|
|
|
|
| 24 |
|
|
|
|
|
- Tracer le graphique 1/VB en fonction de [H3O+] et déterminer graphiquement la pente de cette droite. Puis calculer KA (voir formule plus haut)
- Utiliser un tableur tel que Excel pour calculer, tracer le graphique et imprimer un rapport (feuille exemple à télécharger)
- Comparer les valeurs obtenues avec celles du tableau périodique
 IV) QUELQUES LIENS : IV) QUELQUES LIENS :
 V) LES PRODUITS V) LES PRODUITS
- Nos conseils : reconnaître les pictogrammes, liens, ...
- Base de données pouvant être consultée : ChemExper
- Les "safety sheets" MSDS des composés chez EnviroNet
Hydroxyde de sodium
NaOH
solution 0,1M |
M : 40,00
R35 provoque des brûlures
S26-27-37/39 en cas de contact avec les yeux, laver abondamment á l'eau
enlever immédiatement tout vêtement souillé
porter des gants
|
Méthanoïque
HCOOH
|
M : 46,03
R35 provoque des brûlures
S23-26 ne pas respirer-en cas de contact avec les yeux, laver abondamment á l'eau
|
Ethanoïque
CH3COOH
|
M : 60,05
R10-35 inflammable-provoque des brûlures
S23-26 ne pas respirer-en cas de contact avec les yeux, laver abondamment á l'eau
|
|


 @t
home, ressources scientifiques ( 04/2000 )
@t
home, ressources scientifiques ( 04/2000 )

 @t
home, ressources scientifiques ( 04/2000 )
@t
home, ressources scientifiques ( 04/2000 )