|
 I) INTRODUCTION
I) INTRODUCTION
Bien que les phénomènes électriques aient été observés dès l'Antiquité (par frottement d'un morceau d'ambre, elektron en grec, sur de la fourrure) ce n'est que vers 1800 que Alessandro Volta (suite aux travaux de Luigi Galvani sur l'électricité animale) réalisa ses premières piles à base de disques métalliques et de solutions salines.
Le but de cette manipulation est de réaliser une pile rudimentaire similaire à celles réalisées par Volta.
II) MANIPULATION
Partie 1 : Produits et matériel nécessaires
- matériel : voltmètre, ampèremètre, cordons, béchers, électrodes (lames) de cuivre et zinc, tube en U.
- préparer des solutions CuSO4 et ZnSO4 0,1M
- décaper des lames de cuivre et de zinc
- préparation d'un pont électrolytique
- faire bouillir 250ml d'eau (pour 2 ponts)
- dissoudre dans la solution bouillante 25g de KNO3 ou KCl
- arrêter de chauffer. Dissoudre 5g d'agar-agar. Agiter.
- remplir à ras bord les tubes en U avec la solution 10% en KNO3 et 2% en agar-agar
- laisser refroidir
- le pont peut être conservé plusieurs jours. Evitez cependant le dessèchement des extrémités.
 Partie 2 : Activités Partie 2 : Activités
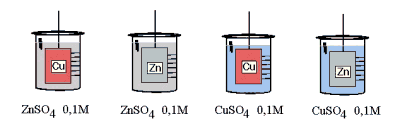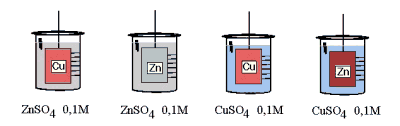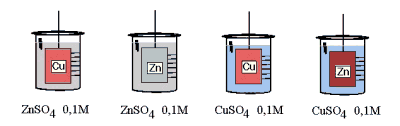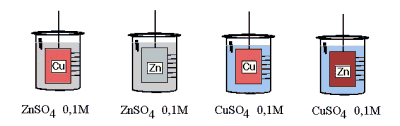 - Activité 1: Quelle réaction ?
Dans un berlin, on introduit 250ml de solution CuSO4 ou ZnSO4 et on plonge une tige métallique (cuivre ou zinc). Que se passe-t-il ? Y a-t-il réaction ? La décrire.
On constate un dépôt noir de cuivre sur l'électrode de zinc plongée dans la solution de sulfate de cuivre. La réaction est
Zn° + Cu2+  Zn2+ + Cu° Zn2+ + Cu°
- Activité 2: Montage de la pile
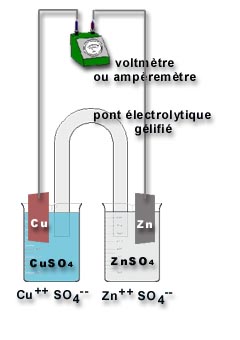
Réaliser le montage comme sur le schéma ci-dessous (photo 69ko).
On place d'abord un ampèremètre dans le circuit extérieur. Observe-t-on un courant électrique ? La très faible intensité est due à la résistance interne très élevée. Il serait possible avec cette pile de faire fonctionner une montre à affichage digital ou encore une carte musicale.
On remplace l'ampèremètre par un voltmètre. On mesure ainsi la tension de la pile (1,1 V).
Cette valeur est en accord avec les potentiels normaux des deux couples redox
- Cu/Cu++ E°=0,345V
- Zn/Zn++ E°=-0,763V
 III) LIENS III) LIENS
 IV) LES PRODUITS IV) LES PRODUITS
Sulfate de cuivre pentahydraté
CuSO4.5H2O
| M : 249,68
R22 nocif en cas d'ingestion
R36-38 irritant pour les yeux et la peau
S22 ne pas respirer les poussières
|
Sulfate de zinc monohydraté
ZnSO4.H2O
| M : 179,45
R22 nocif en cas d'ingestion
S24-25 Eviter le contact avec les yeux et la peau
|
Agar-agar
Gélatine végétale, gélose
|
|
|


 @t
home, ressources scientifiques (maj 02/2009)
@t
home, ressources scientifiques (maj 02/2009)

 @t
home, ressources scientifiques (maj 02/2009)
@t
home, ressources scientifiques (maj 02/2009)