|
 Présentation de la manipulation
Présentation de la manipulation
La chimie des matières plastiques a un rôle industriel très important. En 1980, la production mondiale de matières plastiques atteignait, en suivant une croissance exponentielle, 50 millions de tonnes. Les matières premières (styrène, éthylène, butadiène,... voir les chiffres de la Société française de Chimie, section Info) sont fournies par l'industrie du pétrole dont approximativement 4% sont utilisés pour fabriquer les plastiques.
Chimiquement parlant, les plastiques sont des macromolécules (plus de 1000 atomes par molécules) dont les propriétés découlent de l'agencement particulier des molécules géantes.
On distingue
- les thermoplastiques formés de molécules linéaires ou ramifiées dont la mise en forme (sous l'effet de la chaleur peut être réversible),
- les thermodurcissables de structure réticulée (la mise en forme se fait une fois pour toute) et les élastomères.
Les processus de synthèse peuvent suivre deux voies
- par polyaddition : Les monomères ou molécules de base possèdent des liaisons doubles qui vont s'ouvrir.
- par polycondensation : Les monomères sont difonctionnels. Ces groupements vont réagir deux à deux avec élimination de petites molécules comme l'eau ou le dioxyde de carbone. C'est le cas du nylon : entre un chlorure d'acide (plus réactionnel que le diacide) et une diamine.
Nous allons réaliser la synthèse du nylon (plus d'infos à MacroLab). Pratiquement nous allons mettre en contact une solution aqueuse de diamine et une solution de chlorure d'acide dans un solvant organique. Ces deux solutions n'étant pas miscibles, la polymérisation aura lieu à l'interface (polymérisation interfaciale).
En réalité le nylon n'est pas préparé de cette manière car les chlorures d'acide sont coûteux et relativement toxiques (odeur ...) et le nylon réalisé par cette voie est de piètre qualité.
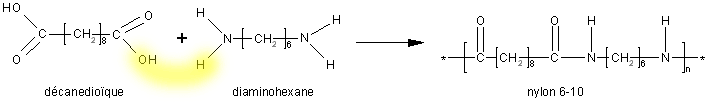
 Mode opératoire Mode opératoire
- Dans une fiole conique, réaliser une solution à 5% de diaminohexane dans NaOH 0,5M (par exemple 1g de diaminohexane + 10ml d'eau + 10ml NaOH 0,1M).
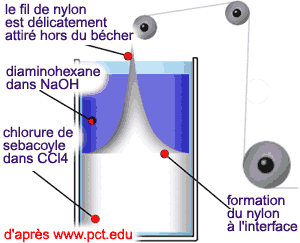 Dans un berlin de 50ml, introduire 20ml d'une solution à 5% de chlorure de sébacoyle ( le chlorure d'acide - OH remplacé par Cl - est plus réactionnel que l'acide ) dans CCl4 (ou dichlorométhane) Dans un berlin de 50ml, introduire 20ml d'une solution à 5% de chlorure de sébacoyle ( le chlorure d'acide - OH remplacé par Cl - est plus réactionnel que l'acide ) dans CCl4 (ou dichlorométhane)
- Ajouter délicatement 20ml de la solution de diaminohexane à la solution de chlorure d'acide (avec précaution pour ne pas mélanger les phases organique et aqueuse. La phase aqueuse à une densité inférieure à la phase organique).
- Saisir au moyen de la pince le film qui se forme à l'interface et faire émerger le fil qui s'allonge spontanément. Enrouler lentement ce dernier autour d'un tube à essai jusqu'à épuisement de la solution.
- Dérouler le fil, le laver dans une solution aqueuse d'acide acétique à 5%, rincer à l'eau et sécher
 Liens Liens
 Les produits Les produits
Hydroxyde de sodium
NaOH
Solution 1M | M : 40,00
R35 provoque des brûlures
S26-27-37/39 en cas de contact avec les yeux, laver abondamment á l'eau
enlever immédiatement tout vêtement souillé
porter des gants
|
Dichlorure de sebacoyle
ClOC(CH2)8COCl
| M : 239,14
R34 provoque des brûlures
S26 en cas de contact avec les yeux, laver abondamment á l'eau et consulter un spécialiste
|
Diamino -1,6 hexane
NH2(CH2)6NH2
| M : 116,21
R21/22 nocif par contact avec la peau et par inhalation
R34 provoque des brûlures
R37 irritant pour les voies respiratoires
S36/37/39 porter des gants et un appareil de protection des yeux
S22 ne pas respirer les poussières
S26 en cas de contact avec les yeux, laver immédiatement avec de l'eau et consulter un spécialiste
S45 en cas de malaise, consulter un spécialiste et lui montrer l'étiquette
|
|


 @t
home, ressources scientifiques (05/2000)
@t
home, ressources scientifiques (05/2000)

 @t
home, ressources scientifiques (05/2000)
@t
home, ressources scientifiques (05/2000)