 I) INTRODUCTION I) INTRODUCTIONLe jus de citron contient essentiellement 3
acides dont 2 (l'acide malique et l'acide ascorbique) sont en teneurs faibles face au
troisième l'acide citrique (± 6,08g d'acide citrique pour 100g de jus). On considère
que ce dernier intervient pour 95% de l'acidité globale du citron.

L'acide citrique est un triacide. Ce
laboratoire nous permettra d'observer la courbe de neutralisation de ce polyacide
La neutralisation totale de ce triacide se
fait en trois étapes correspondant aux trois couples acide/base. Les trois couples
ont des pKa très proches (3,13 ; 4,76 ; 6,40).
Dans cette manipulation, il serait intéressant
- d'observer l'influence de la proximité
des pKa sur l'aspect de la courbe de neutralisation
- de vérifier si l'utilisation de la
phénolphtaléine comme indicateur est adéquate.
II) LIENS :
III) LA MANIPULATION :
Avant de commencer n'oubliez pas de prendre connaissance des consignes de
sécurité.
Les valeurs expérimentales sont celles
obtenues par des élèves de la section sciences appliquées du Centre
Educatif de la Sainte-Union en mars 1999
- Préparer une solution de NaOH 0,1M
- Presser convenablement (le plus complètement possible) un
jus de citron. Filtrer le jus sur ouate dans un entonnoir. Recueillir le filtrat dans une
éprouvette graduée de 50ml. Noter le volume de jus recueilli.
Valeurs expérimentales |
volume de jus [ml] |
33ml |
masse de jus [g] |
33,3ml |
masse volumique du jus [g/ml ] |
1g/ml |
- Titrage n°1 (avec indicateur) : Pipetter 1ml du
jus de citron et l'introduire dans un petit bécher. Ajouter 20ml d'eau distillée et
quelques gouttes de phénolphtaléine. Titrer par NaOH 0,1M et relever le plus exactement
le point équivalent. Recommencer une ou deux fois.
Valeurs expérimentales |
titrage |
volume NaOH 0,1M |
1 |
8,65ml |
2 |
8,75ml |
3 |
8,7ml |
moyenne |
8,7ml |
- Titrage n°2 (avec pH-mètre) : Procéder
comme dans le point précédent mais sans phénolphtaléine. Plonger l'électrode dans le
bécher et ajouter progressivement ±15ml NaOH 0,1M (fractions de 0,5ml).
Valeurs expérimentales |
Volume NaOH 0,1M |
pH |
Volume NaOH 0,1M |
pH |
0 |
2,8 |
8,5 |
9,8 |
2 |
3,5 |
9 |
10,6 |
3 |
4 |
9,5 |
11 |
5 |
4,9 |
10 |
11,2 |
6 |
5,4 |
10,5 |
11,3 |
6,5 |
5,7 |
11 |
11,4 |
7 |
5,9 |
12 |
11,5 |
7,5 |
6,3 |
13 |
11,6 |
8 |
6,7 |
14 |
11,6 |
IV) EXPLOITATION DES RESULTATS
:
- Tracer la courbe de neutralisation en y représentant la
zone de virage de la phénolphtaléine. justifiez son utilisation. Repérez
l'équivalence.
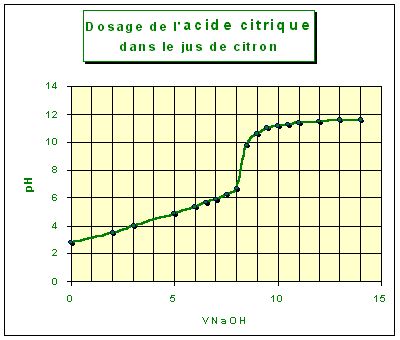
- Comparer les équivalences obtenues dans les titrages.
Valeurs expérimentales |
Titrage |
V NaOH [ml] |
C ac.citrique [mole/l] |
avec phénolphtaléine |
8,7 |
|
avec pH-mètre |
8,4 |
|
- Evaluer la masse d'acide citrique présent dans un citron et
comparer avec la valeur des tables N'oubliez pas que
- l'acide citrique est un triacide
- qu'il intervient à 95% dans l'acidité totale
- que la teneur est exprimée par 100g de jus (ce qui implique la détermination de la
masse volumique du jus de citron. Comment ?)
V) LES PRODUITS
- Nos conseils : reconnaître les pictogrammes, liens, ...
- Base de données pouvant être consultée : ChemExper
- Les "safety sheets" MSDS des composés chez EnviroNet
Hydroxyde de sodium
NaOH
solution 0,1M |
M : 40,00
R35 provoque des brûlures
S26-27-37/39 en cas de contact avec les yeux, laver abondamment á l'eau
enlever immédiatement tout vêtement souillé
porter des gants
|
|


 @t
home, ressources scientifiques (maj.08/2000)
@t
home, ressources scientifiques (maj.08/2000)

 @t
home, ressources scientifiques (maj.08/2000)
@t
home, ressources scientifiques (maj.08/2000)